Nitratos, nitritos, nitrosaminas: últimas investigaciones e historia de los conservantes
Recientemente descubrí que todos los aditivos alimentarios pasan periódicamente por una reevaluación sistemática. Se complementan con los resultados de investigaciones previas y, de vez en cuando, se revisa el ADI. A la luz de la reciente revisión del nitrito (E 249-250) y nitrato (E 251-252) por parte de la EFSA, finalmente entendí sobre ellos. En esta revisión, intentaré describir de manera objetiva los beneficios y daños del nitrito de sodio y los nitratos: los conservantes más demonizados, sus ventajas y riesgos desde el punto de vista de las consecuencias a largo plazo para la salud humana.
Si te da pereza leer, al final del artículo hay un resumen breve de la misma.
El material se basa en datos de la ciencia y medicina basadas en evidencia. La lista de literatura, enlaces y traducciones de fuentes se encuentran al final del artículo.
¿Por qué se añaden nitratos y nitritos a los alimentos?
Las sales de nitrito y nitrato se añaden a los productos cárnicos como conservantes y agentes antibacterianos contra microorganismos que producen la toxina botulínica y otros organismos patógenos peligrosos. Como bonificación, el aditivo E-250 le da al producto un sabor y color característicos.
¿Por qué carne? Clostridium botulinum encuentra en la carne un ambiente ideal: ausencia de aire, calor, humedad. Por ejemplo, como en las salchichas o un frasco de encurtidos. Curiosamente, gracias a los nitritos, los productos cárnicos industriales han estado en el extremo inferior de la lista de fuentes de intoxicación por toxina botulínica durante los últimos 50 años. Los encurtidos caseros encabezan la lista.
El color rosado que adquiere la carne tratada es el resultado de la interacción del pigmento de mioglobina con los nitritos añadidos: el óxido de nitrógeno que se forma a partir del nitrito reacciona con el pigmento y lo transforma en otra forma: nitrosogemocromo.
 El color rosado de la carne tratada resulta de la reacción entre NO3 y el pigmento de la carne.
El color rosado de la carne tratada resulta de la reacción entre NO3 y el pigmento de la carne.
No solo Doctor. Fuentes reales de nitratos y nitritos
Los vegetales y el agua potable son las principales fuentes de nitratos en la dieta, mientras que los conservantes añadidos constituyen no más del 5% del total obtenido de forma “natural”. Los nitratos llegan al agua gracias a la acción de los microbios que oxidan el amoníaco en el suelo. Las fuentes de amoníaco, a su vez, son las plantas en descomposición, el estiércol, los gases de escape de los automóviles y los productos de combustión, así como los fertilizantes nitrogenados.
A pesar de la reducción generalizada en el uso de fertilizantes nitrogenados, la cantidad de nitratos en las aguas subterráneas no disminuye. Al parecer, la salitre no es la fuente principal de contaminación. Por cierto, el agua del grifo generalmente contiene mucho menos nitrato que la de pozos privados y cisternas.
Una dieta equilibrada rica en vegetales de hojas puede exceder significativamente el límite de nitratos, y eso está bien.
Cabe destacar que el nivel de nitrito en los vegetales aumenta durante su almacenamiento, ya que los nitratos se convierten en nitrito (NO3 pierde una molécula de oxígeno -> NO2), mientras que en los productos cárnicos el contrario ocurre: el nivel disminuye, convirtiéndose en óxido de nitrógeno (NO). Más sobre esto en la sección de química.
La percepción de estos aditivos cruciales es ambivalente: los temores hacia los conservantes son constantemente alimentados por los medios de comunicación, y no todos están dispuestos a profundizar en la cuestión.
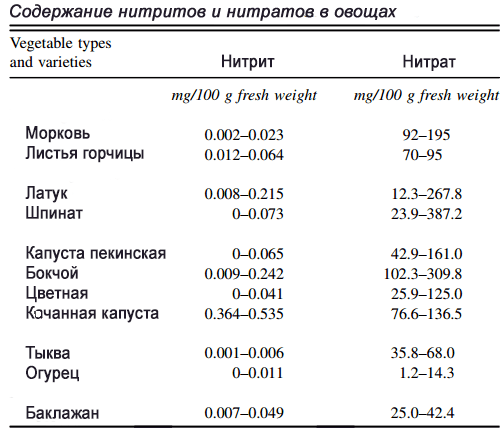
Nitratos en vegetales y frutas
Los vegetales de hojas verdes pueden contener más de 1000 mg de nitratos por kg de vegetales frescos. Los campeones entre los vegetales son plantas comunes: apio, lechuga (3500 mg/kg), remolacha, espinaca (hasta 4259 mg/kg), rúcula, acelga. Las concentraciones dependen de la región de cultivo, la época del año, el uso de fertilizantes y la variedad de la planta. Para comparar, en los productos cárnicos procesados se encuentran de 0.2 a 450 mg de nitrato por kilogramo.
Para más detalles sobre el contenido de nitratos en los alimentos, lea la revisión “Nitrato y nitrito dietético: beneficios, riesgos y percepciones en evolución”, en la sección 2.5 (enlaces a textos en ruso al final del artículo); la monografía IARC vol.94, pp. 46-100; “Fuentes alimenticias de nitratos y nitritos: el contexto fisiológico para posibles beneficios para la salud”, Am J Clin Nutr 2009 90:1–10 Asociación Americana de Nutrición.
Un ejemplo: el jugo de remolacha reduce la presión arterial y fortalece los vasos. Veamos los números: dos vasos de jugo de remolacha al día reducen la presión sistólica de 5.4 a 12 mmHg; la diastólica hasta 10 mmHg. En esta cantidad de jugo de remolacha hay entre 154% y 630% de la dosis diaria de nitratos. El nivel de nitrato en un vaso de jugo de remolacha orgánico varía del 70% al 672% de la dosis diaria; en el no orgánico, del 142% al 1260%.
Estos son solo números; la cantidad de nitratos por sí sola no nos dice nada. Y aquí está la razón: el alto contenido de ácido ascórbico, aminas primarias y compuestos fenólicos en algunos vegetales y frutas impide la formación de otros compuestos a partir del óxido de nitrógeno (NO), precursor de los nitratos, incluidos los nitrosaminas. Esta propiedad se ha estudiado y utilizado para crear una versión segura del aditivo E-250 (más sobre esto a continuación).
La dieta tradicional japonesa contiene en promedio 18.8 mg/kg de masa corporal de nitratos al día, con un ADI de 3.7 mg/kg. Investigaciones realizadas en europeos que siguieron una dieta japonesa bajo supervisión clínica mostraron una disminución en la presión diastólica en promedio de 5 unidades.
Las plantas “nitrato” son parte de una dieta equilibrada, y la industria alimentaria no ha aportado nada nuevo, pero ha podido controlar las propiedades negativas de los conservantes naturales.
Sobre diversos dispositivos, los llamados “nitrato-metros”, lea en Rospotrebnadzor .
Paradojas de marketing: apio en lugar de conservantes
En Canadá y Estados Unidos, gozan de gran popularidad las salchichas que, en lugar del aditivo E-250, utilizan polvo de apio, un acumulador natural de nitratos. Se promocionan las salchichas como más saludables que las que contienen conservantes sintéticos.
 La cantidad de nitrito en estas salchichas puede ser incluso mayor que la regulada.
La cantidad de nitrito en estas salchichas puede ser incluso mayor que la regulada.
Los consumidores que eligen productos “verdes” añaden a su carrito espinacas, apio y jugo de remolacha, sin darse cuenta de que estos vegetales contienen los mismos compuestos químicos que están tratando de evitar en los productos cárnicos procesados (en cantidades que superan con creces el límite para los aditivos conservantes “químicos”).
 Sal de apio o polvo de apio: un sustituto supernitrito del E-250, aumentando el costo del producto varias veces.
Sal de apio o polvo de apio: un sustituto supernitrito del E-250, aumentando el costo del producto varias veces.
El Departamento de Agricultura de EE. UU. regula estrictamente la composición de los productos comercializados bajo la etiqueta “orgánico” y “natural”: no deben incluir componentes sintéticos. Sin embargo, para que el producto siga siendo sabroso, atractivo y seguro, aún deben añadirse conservantes y colorantes… en forma de polvo de apio o cereza acerosa (para que el color también sea aceptable), mezclados con cultivos bacterianos que convierten el nitrato en nitrito. El producto orgánico final debe contener no menos concentración de conservante E-250 que el no orgánico para poder entrar al mercado.
Historia del nitrato y nitrito desde 200 a.C. hasta nuestros días
La carne se ha salado durante 5000 años, pero las primeras evidencias del uso de sales de nitrato se remontan a los romanos alrededor del año 200 a.C. (hay datos de Homero desde 850 a.C.). Los romanos aprendieron a salar la carne de los griegos, pero fueron ellos quienes notaron por primera vez que la sal evaporada de ciertas fuentes favorecía un intenso color rosado en la carne y mejoraba su aroma.
 Relieve romano del siglo II d.C.
Relieve romano del siglo II d.C.
Mucho más tarde se identificó el “contaminante” de la sal como el nitrato de potasio (anteriormente llamado salitre). La composición química del salitre fue determinada por el propio Antoine Lavoisier. Lamentablemente, no puedo detenerme en muchos eventos históricos con más detalle.
Antes de la revolución industrial, los nitratos se obtenían exclusivamente de fuentes naturales: depósitos de todo el mundo, de orina y ceniza, estiércol de murciélagos, una variedad de materia orgánica y suelo. Mucho antes de que el salitre se utilizara en pólvora, ya se empleaba para conservar carne y embutidos. La conservación de la carne era una ciencia exacta que requería experiencia y precisión, ya que la correcta aplicación del conservante dependía no solo del sabor y aspecto del producto, sino también de la vida de los consumidores.
 Tratados antiguos sobre conservación de carne, años 20 del siglo XX.
Tratados antiguos sobre conservación de carne, años 20 del siglo XX.
En esos tiempos, cuando el conservante era el nitrato NO3, su transformación en nitrito NO2 no siempre ocurría de manera efectiva, lo que resultaba en un efecto conservante insuficiente o un nivel de nitratos inadecuadamente alto en el producto final.
La comprensión de cómo funciona el salitre llegó a fines del siglo XIX. En 1891, el Dr. Ed Polensky descubrió la conversión de nitrato en nitrito bajo la influencia de ciertos tipos de bacterias. Esta observación cambió el mundo, ya que se entendió que era el NO2 el que era responsable de la conservación y del color de la carne. En ese momento, también se demostró la inhibición de Clostridium botulinum, la principal causa de graves intoxicaciones por toxina botulínica.
 Inyección de esterilización de carne años 20.
Inyección de esterilización de carne años 20.
La Primera Guerra Mundial trajo sus correcciones. Los ejércitos necesitaban conservas bien almacenadas, pero las municiones eran más importantes. La prohibición del uso de salitre en la industria alimentaria en varios países a favor de las necesidades de producción de armas obligó a los carniceros a recurrir al nitrito (más detalles históricos aquí ).
En 1923, comenzaron una serie de experimentos que determinaron el nivel mínimo de nitrito de sodio necesario para suprimir de manera efectiva las bacterias y mejorar la calidad del producto. Se iniciaron las ventas de un enorme stock militar de nitrito de sodio, o “sal de Praga”. Se comercializa hasta el día de hoy bajo la marca “Powder Prague”.
No faltó un “complot”. Antes de que se aprobara por la FDA, el nitrito se añadía en secreto como conservante durante 1905 en los Estados Unidos.
La OMS estableció el primer ADI para el nitrato en 1962. Según un informe de la FDA que sustentó la limitación, la OMS calculó que 0,5 gramos de nitrato de sodio por kilogramo de peso corporal eran seguros para ratas y perros, y por normas, esta cifra fue dividida por 100 para garantizar una ingesta diaria absolutamente segura para los humanos: 3.7 mg de nitrato de sodio por kilogramo de peso corporal.
El prejuicio moderno sobre estos conservantes se origina en los años 60 y 70, cuando se mostró el potencial cancerígeno de los nitrosaminas en estudios con animales (más abajo habrá una sección específica sobre nitrosaminas).
Se encontró una solución. Se incluyeron antioxidantes en la receta: vitamina E, ascorbato de sodio o su isómero eritrobato, que impiden la formación de nitrosaminas durante la cocción de la carne. A pesar de esto, la aguda negativa hacia la sal nitritada se perpetuó en los medios de comunicación, que especulaban sobre sensaciones y evitaban desmentidos.
En los años 80, se comprendió la importancia del óxido nítrico y sus metabolitos en una serie de procesos fisiológicos, reconsiderándose el papel del nitrato y el nitrito. Pero el tema de “el nitrito causa cáncer” regresaba una y otra vez por diversas razones, obteniendo cada vez más pruebas de la seguridad de los aditivos, pero sin convencer al gran público. Mientras tanto, los brotes de botulismo se volvieron eventos extremadamente raros, y solo gracias a los conservantes a base de nitratos.
Si te interesa el aspecto histórico del uso de la sal nitritada, lee más: Nitrato y nitrito – su historia y funcionalidad .
La química del óxido nítrico (NO), nitritos y nitratos
El nitrato NO3 es un ion que está ampliamente distribuido en el medio ambiente. Se forma a partir del monóxido de nitrógeno (NO). NO es un compuesto natural que se sintetiza en el organismo a partir del aminoácido arginina, y también se obtiene del alimento y el agua.
El nitrato y el nitrito son parte del ciclo del nitrógeno, el nitrato se convierte en nitrito al perder una molécula de oxígeno bajo la influencia de bacterias y otros procesos. El ciclo del nitrógeno incluye N-nitrosaminas, N-nitrosamidas y otros compuestos nitrogenados.
El papel del óxido nítrico en los procesos fisiológicos es enorme. NO es una molécula señalizadora que puede atravesar fácilmente la membrana celular e interactuar con proteínas receptoras, participando en la “transmisión de eventos” en la célula. El compuesto influye en varios procesos simultáneamente (molécula señalizadora pleiotrópica).
Funciones del óxido nítrico y sus metabolitos:
- Regula la presión arterial y el flujo sanguíneo (recuerda las gotitas de nitratos en cardiología y el nitroglicerina);
- Mantiene el tono de los vasos sanguíneos;
- Evita la aglutinación de plaquetas;
- Participa en la transmisión de impulsos nerviosos y el proceso energético en mitocondrias, así como en el funcionamiento del sistema inmunológico, endocrino y la retina;
- Su participación acelera la recuperación de los vasos tras la isquemia, además de que NO participa en la relajación del músculo liso de los vasos;
- Reduce la inflamación microvascular;
- Alivia el estrés oxidativo;
- Estimula la producción de moco protector en el tracto gastrointestinal y aumenta el flujo sanguíneo en la mucosa del estómago;
- Reduce el riesgo de diabetes tipo 2 y del síndrome metabólico (hasta ahora demostrado solo en animales de laboratorio);
- Actualmente se estudian los efectos de NO en la regeneración del hígado y músculo cardíaco. Se investiga la posible conexión con la fibrosis quística, enfermedades auditivas y los dolores de cabeza en racimo (el efecto secundario más común de los medicamentos de nitrato).
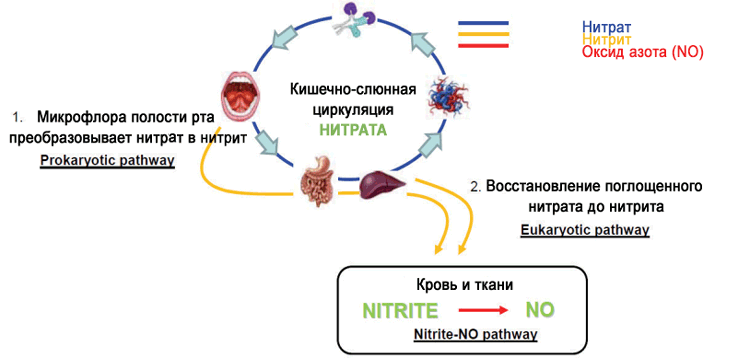
Qué sucede con los nitratos en el organismo
La biosíntesis de nitratos en el cuerpo humano se describió por primera vez en los años 80. Se demostró que el monóxido de nitrógeno puede oxidarse a nitrato y nitrito, y estos últimos pueden regenerarse parcialmente en NO activo y detectarse en sangre, orina y tejidos.
Parte de los nitratos absorbidos con agua y alimentos se excretan sin cambios. Las bacterias en la cavidad bucal pueden captar parte del nitrato de los alimentos durante la masticación y convertirlo en nitrito (6-7%), que se transfiere a través de las glándulas salivales (hasta un 25%). En la saliva, el nivel de NO3 puede ser 20 veces mayor que en el plasma sanguíneo.
¿Por qué necesitamos el mecanismo de captura de nitratos? Hay una teoría y algunas investigaciones que la apoyan, que sugiere que es una de las formas de inmunidad centrada en la saliva y la cavidad bucal: el NO3 dietético, convertido en NO2, protege contra patógenos externos y aquellos que pueden vivir en el entorno agresivo del estómago. Además, de este nitrito estable (con un tiempo de vida media de 5 a 8 horas), el organismo puede sintetizar óxido nítrico en cualquier momento si es necesario (con un tiempo de vida media de 0,05 a 1,18 ms).
Los nitratos que ingresan con los alimentos sirven como fuente alternativa de nitrógeno, además de la arginina. Hablando de bacterias: el enjuague bucal después de comer reduce la cantidad de nitrito en el plasma y eleva ligeramente la presión en ratas y humanos.
El nitrito se encuentra en la composición química de la leche materna en los primeros días tras el parto. De hecho, los bebés alimentados con leche materna reciben casi 1 mg/kg de masa corporal al día, que supera más de diez veces el ADI. El nitrito en la leche materna protege a los infantes de bacterias patógenas durante el periodo antes de que se colonice su microbiota, capaz de sintetizar NO2 por sí misma, y también actúa como una fuente de óxido nítrico que previene la hipoxia.
Los procesos inflamatorios en el organismo afectan al metabolismo de los compuestos. Infecciones, parásitos y enfermedades autoinmunes inflamatorias aumentan la biosíntesis de óxido nítrico, nitratos y nitritos.
El nivel de NO2 en el jugo gástrico está directamente relacionado con su acidez: si hay insuficiente ácido, crece la población de bacterias en el estómago que reducen NO3. Se desencadena una compleja reacción en cadena que lleva a un aumento de los niveles de nitratos. Las bacterias patógenas en los riñones y la vejiga también pueden realizar esta función.
Algunos de los compuestos nitrogenados reducidos pueden aumentar la tasa de mutaciones y la apoptosis celular, interfiriendo con la captura de oxígeno por parte de la hemoglobina. Los efectos negativos dependen directamente del número de nitratos que entran al organismo desde el exterior o que son sintetizados por nuestra microbiota a partir del óxido nítrico.
Pequeñas cantidades de nitrito pueden transformarse en un grupo de compuestos llamados nitrosaminas. Algunas nitrosaminas tienen potencial cancerígeno. En el monográfico IARC vol.94 se describe en detalle la bioquímica y farmacología de nitratos y nitritos en la sección 4.1 Absorción, distribución, metabolismo y excreción.
El uso de nitratos en medicina está descrito en la publicación del Instituto Sueco de Farmacología Inorganic And Organic Nitrates As Sources Of Nitric Oxide, sección 1.3.1.
Nitratos, nitritos, nitrosaminas y cáncer
El papel del óxido nítrico y sus derivados en el cancerogénesis se estudia activamente desde hace más de 50 años. Los nitritos y nitratos en sí no causan cáncer, pero pueden formar compuestos cancerígenos denominados nitrosaminas (más detalles en el informe IARC, sección 4.3).
En 2010, la Agencia Internacional para la Investigación del Cáncer (IARC) clasificó a los nitritos en [tooltip tip=“Esta categoría se utiliza para agentes para los cuales existe evidencia limitada de cancerogénesis en humanos y menos que suficiente evidencia de cancerogénesis en animales de experimentación.”]grupo 2B[/tooltip]: posiblemente cancerígenos para los humanos, junto con “trabajo en turnos nocturnos” y “emisiones de motores diésel”. En la gran mayoría de estudios, los animales de laboratorio fueron expuestos a nitritos a través de sondas o agua potable. La comparación con el grupo de control no muestra crecimiento de tumores ( informe IARC). Sin embargo, actualmente el riesgo para los humanos se evalúa a partir de la suma de fuentes de nitrosaminas, no solo a través de productos alimenticios; las condiciones laborales, el tabaquismo y otros factores se consideran en conjunto.
La FDA tuvo en cuenta este posible impacto y limitó la cantidad permitida de nitritos a 700 partes por millón (0,07%) 1 . Además, la adición de antioxidantes eritrobato y ascorbato (que “utilizan” las plantas en la naturaleza) previene la formación de nitrosaminas.
Los nitritos que ingresan desde el exterior son muy bajos como para representar un peligro para la salud. La mayor parte de ellos se sintetiza en el propio organismo a partir de otros compuestos nitrogenados. Para la mayoría de los consumidores, esta es toda la información que necesitan conocer sobre la seguridad de los conservantes de la carne, pero ¿por qué no profundizar más!? Todo lo que la ciencia sabe sobre este tema se encuentra en el informe IARC vol.94 en secciones 2-5.
El impacto de los compuestos nitrogenados en el organismo varía en función de la participación de ciertos catalizadores, inhibidores, la presencia de procesos inflamatorios, el pH del medio, la cantidad y el tipo de bacterias capaces de formar nitrito y nitrosaminas a partir de nitrato. Posiblemente, esta sea la razón por la que los estudios sobre tumores a menudo muestran resultados completamente opuestos (para tales experimentos, se han creado razas específicas de ratas con predisposición a diferentes formas de cáncer, que sufren por nosotros).
Dependiendo de la concentración de nitrógeno y del tipo de tejidos circundantes al tumor, el nitrógeno puede tanto suprimir el crecimiento de células mutadas como provocarlo. A altas concentraciones, los compuestos N-nitrosos provocan mutaciones y trastornos en el desarrollo embrionario en varias especies animales.
Existe una correlación entre el aumento del riesgo de desarrollar cáncer colorrectal y el alto consumo de carne roja y productos cárnicos (lo que significa “alto consumo” no lo he averiguado). Solo tenemos datos epidemiológicos a nuestra disposición, no se pueden realizar estudios completos en humanos. Según estos datos, el papel de los compuestos de nitrógeno en la carcinogénesis no está completamente confirmado.
El estudio del “cáncer tabáquico” en animales de laboratorio ha demostrado la carcinogenicidad de los nitrosaminas, que se encuentran en abundancia en el tabaco y el humo del tabaco. La nornicotina y el nitrito se convierten en N-nitrosonornicotina (NNN), un nitrosamina-carcingógeno específico del tabaco. Este no se encuentra en la comida y el medio ambiente, solo está presente en el humo del tabaco y en algunos medicamentos para tratar la adicción basados en nicotina. La relación entre la cantidad de N-nitrosonornicotina en la orina de los fumadores y el riesgo de desarrollar cáncer de esófago es extremadamente alta. Si fumas, pero no comes salchichas debido al E-250, entonces…
Cito 2 estudios a largo plazo. Un estudio de dos años observando a 100 ratas divididas en 3 grupos, que recibieron 0%, 2.5% y 5% de nitrato de sodio del total de la dieta diaria durante 2 años a partir de 8 semanas de vida (equivalente a 0, 1259 y 2500 mg de nitrato de sodio por kg de peso corporal al día). No se encontraron bases suficientes para afirmar su carcinogenicidad.
El nitrito de sodio fue evaluado por el Programa Nacional de Toxicología de EE.UU. durante 2 años en ratones y ratas, con 100 individuos en 4 grupos. Se les añadía diariamente al agua 0, 35, 70 o 130 mg de nitrito de sodio/kg de peso corporal a los machos y 40, 80 o 150 mg de nitrito de sodio/kg de peso corporal a las hembras. Se probó la carcinogenicidad solo en combinación con aminas y amidas, y algunos resultados en machos fueron contradictorios.
Nitrito y metahemoglobinemia
La metahemoglobinemia se produce cuando el nitrito reacciona con la hemoglobina, impidiendo que esta transporte oxígeno. La enfermedad solo representa un riesgo en casos graves de intoxicación a través de agua contaminada, o es congénita. El único caso de epidemia de metahemoglobinemia ocurrió en los años 50, cuando el estiércol de vaca con bacterias que convertían nitrato en nitrito contaminó los pozos, y se prepararon fórmulas lácteas en esta agua para lactantes. La anemia nunca se ha asociado directamente con el aditivo conservante, y además, esta enfermedad es muy rara.
La única razón por la que los productos cárnicos son seguros
Un inmenso flujo de información y títulos sensacionalistas confunden a los consumidores. Las fobias alimentarias, los trastornos provocados por el miedo a la comida y la quimiofobia son fenómenos cada vez más comunes. Sin embargo, los brotes de botulismo se han convertido en una gran rareza, gracias al E-250.
Nos hemos vuelto demasiado descuidados y superficiales, rechazando vacunas y conservantes que salvan nuestras vidas cada día, y al mismo tiempo somos excesivamente cautelosos, limitando nuestra dieta y privándonos de muchos nutrientes beneficiosos. Pero para reflexionar seriamente sobre esto, se necesita el deseo de saber más allá de lo que informan los titulares.
Renunciar por completo a las salchichas, a la salchicha “Doctor” y al jamón no es difícil, pero debemos recordar que el 95% de los nitritos y nitratos los consumimos con verduras y agua, y eso es normal. La molécula de nitrito “natural” y la sintetizada por el hombre son idénticas, no presentan diferencias - esto lo aprendimos en las primeras lecciones de química en la escuela. ¡No permitas que nadie cultive miedos infundados en ti!
Literatura
Este artículo se basa en materiales y publicaciones de la Agencia Europea de Seguridad Alimentaria EFSA; Food Research Institute, Universidad de Wisconsin, EE.UU.; Molecular Nutrition & Food Research Journal; The American Journal of Clinical Nutrition; Universidad Estatal de Oklahoma, División de Ciencias Agrícolas y Recursos Naturales.
Como es tradición, para todos los materiales hice una traducción automática y los subí a GoogleDrive . Recomiendo que consulten los originales, ya que no pude incluir muchos detalles en el artículo.
En Google Drive hay documentos como:
- Dietary Nitrate and Nitrite: Benefits, Risks, and Evolving Perceptions (revisión del Food Research Institute, Universidad de Wisconsin, EE.UU., 2016);
- EFSA explains risk assessment nitrites and nitrates added to food (revisión de la Autoridad Europea de Seguridad Alimentaria, respecto a la revisión programada de aditivos, 2017);
- Nitrate and nitrite in the diet: How to assess their benefit and risk for human health (Molecular Nutrition & Food Research Journal, 2014) Food sources of nitrates and nitrites: the physiologic context for potential health benefits (The American Journal of Clinical Nutrition, 2009);
- Meat Curing (recomendaciones sobre el tratamiento de la carne con sal nitrita por Frederick K. Ray, Especialista en Alimentos de Animales, de la Universidad de Oklahoma, con antecedentes históricos y recetas específicas).
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, VOLUME 94 Ingested Nitrate and Nitrite and Cyanobacterial Peptide Toxins, 2010.
- Food sources of nitrates and nitrites: the physiologic context for potential health benefits.
Resumen del contenido
- El conservante nitrito de sodio E-250 es el único aditivo permitido que controla eficazmente el crecimiento de bacterias que producen botulinotoxina.
- En ciertas condiciones, los nitritos pueden formar nitrosaminas, las cuales aumentan el riesgo de cáncer. Sin embargo, la adición del eritrobato de sodio (también conocido como ácido ascórbico o E-300) hace imposible el proceso de conversión de Nitrito a Nitrosamina. En pocas palabras, las nitrosaminas del nitrito “cárnico” no se sintetizan.
- En el producto cárnico procesado, queda casi cero de nitrito, ya que el compuesto es parte del ciclo del nitrógeno. No siempre se puede detectar la adición a través de pruebas de laboratorio.
- La dosis de nitrito en un kilogramo de espinacas frescas puede conservar 50 kg de jamón.
- GOST 23670-79 para la salchicha “Doctor”, que estuvo vigente desde 1981 hasta 2005, excedía la norma permitida de nitritos en un 40%. Esta es una aclaración para los nostálgicos de la época soviética sin químicos.
- En el siglo XXI, no se añaden nitratos a la carne, ya que el proceso de conservación con ellos lleva varias semanas, mientras que con el nitrito solo 12 horas.
- El nitrito es la única razón por la que no han desaparecido del mercado los ahumados, beicón, salchichas, prosciutto, salami y otros delicatessen cárnicos.